
Precavidos
Simulador de Exámenes
Simuladores
Banco de Preguntas
Practica con el Primer Simulacro Nacional
En el siguiente gráfico se muestra la variación de la presión de vapor a medida que aumenta la temperatura de dos soluciones (P y Q) formadas por la misma masa de un soluto X y los solventes puros W y Z, respectivamente. Además de las curvas de las dos soluciones, se muestran las curvas de los solventes puros W y Z.
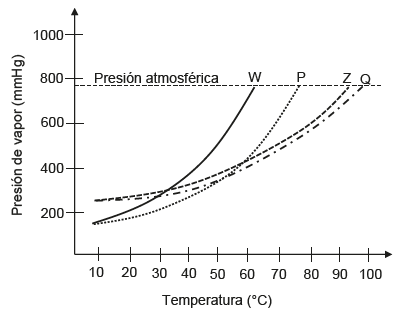
Al respecto, ¿cuál de las siguientes afirmaciones es una conclusión correcta?
DEMRE / Universidad de Chile (2020). Modelo de Prueba de Ciencias Química.
El mayor cambio en la temperatura de ebullición se produjo al adicionar el soluto X al solvente puro Z.
La solución P tiene una temperatura de ebullición sobre los 80°C.
A presión atmosférica, ambas soluciones logran su temperatura de ebullición sobre los 90°C.
La temperatura de ebullición de ambas soluciones es mayor que la de sus solventes puros.
Aún no hay soluciones para esta pregunta. ¡Sé el primero en agregar una!
No te pierdas la oportunidad de ayudar a los demás. ¡Regístrate o inicia sesión para agregar una solución!
Ayuda a la comunidad respondiendo algunas preguntas.
¿Cuál de las siguientes estructuras representa al cis-2-buteno? DEMRE / …
El porcentaje en masa de cada elemento que forma parte …
Un estudiante está investigando acerca de las ondas superficiales que …
¿Cuál de los siguientes procesos industriales corresponde a una aplicación …
En la siguiente figura se presentan dos ciudades, L y …
Una mujer sana desea usar un método anticonceptivo que, además, …
En un ecosistema marino, se investigó la relación establecida entre …
Conociendo solo el volumen de una solución, ¿cuál de las …
El gráfico muestra la cantidad de kilobases presentes en los …
Un grupo de estudiantes analiza el comportamiento de una magnitud …
Prueba tu conocimiento, resuelve estos simuladores similares al examen Transformar
Realiza una pregunta y entre todos de esta comunidad la responderemos.
Prepárate con ejercicios adicionales